Análisis de los sistemas termodinámicos para la generación de energía.
Resumen
Históricamente, la ciencia de la termodinámica se desarrolló para proporcionar un mejor conocimiento de los dispositivos, conocidos como máquinas térmicas, que absorben calor desde una fuente de alta temperatura y producen trabajo útil. En el presente trabajo se examinan los sistemas empleados en la generación de energía.
Palabras clave: Eficiencia térmica, ciclo de Carnot, ciclo Otto, ciclo Diesel, ciclo Brayton.
Abstract
Historically, the science of thermodynamics was developed to provide a better understanding of the devices, known as heat engines, which absorb heat from a high temperature source and produce useful work. In this study the systems used in power generation are discussed.
Keywords: Thermal efficiency , Carnot cycle , Otto cycle , Diesel cycle, Brayton cycle.
1. Introducción
Una sociedad industrializada consume grandes cantidades de energía. Esto es particularmente cierto en el caso de sociedades industrializadas avanzadas, por ejemplo, Estados Unidos de América, teniendo el 6% de la población mundial, consume un tercio de la energía total consumida en el mundo[1]. Además, una sociedad del tipo mencionado se caracteriza por su creciente dependencia de la electricidad, tendencia esta última que tiene efectos directos en el consumo global de la energía y efectos indirectos en el medio ambiente. Como consecuencia de lo anterior, las múltiples decisiones que debemos tomar en relación con el diseño de un sistema total de conversión de energía se ven estrechamente ligadas al comportamiento de nuestra economía y a nuestra calidad de vida en el ambiente [1-10]. El objetivo del presente estudio es determinar las eficiencias térmicas de los ciclos termodinámicos (Carnot, Otto, Diesel y Brayton), empleando la primera ley de la termodinámica, ley de gas ideal y la ley que describe a los procesos adiabáticos, para simplificar la deducción de la eficiencia térmica.
2. Modelos matemáticos de los ciclos termodinámicos
2.1 Ciclo de Carnot
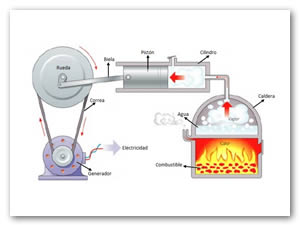
El teorema de Carnot establece que el rendimiento de una máquina térmica (ver Figura 1) es siempre menor o igual que el de una máquina térmica reversible que opere entre las mismas temperaturas.
Como corolario, el rendimiento de todas las máquinas térmicas reversibles que operen entre las mismas temperaturas es el mismo, independientemente del sistema físico que corresponda a la máquina. Puede ser un gas ideal sometido a compresiones o expansiones, puede ser un material paramagnético sometido a campos magnéticos variables, puede ser un sistema bifásico formado por agua y vapor de agua… el resultado es siempre el mismo. Este resultado, ya de por sí bastante contundente, nos permite además calcular el rendimiento máximo que puede tener una máquina térmica. Nos basta con diseñar una máquina térmica reversible y hallar su rendimiento. El de todas las demás reversibles será el mismo, y el de las irreversibles será menor. Para conseguir la máxima eficiencia la máquina térmica que estamos diseñando debe tomar calor de un foco caliente, cuya temperatura es como máximo Tc y verter el calor de desecho en el foco frío, situado como mínimo a una temperatura Tf.
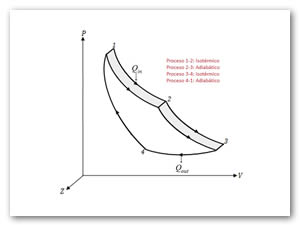
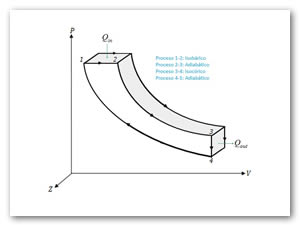
Para que el ciclo sea óptimo, todo el calor absorbido debería tomarse a la temperatura máxima, y todo el calor de desecho, cederse a la temperatura mínima. Por ello, el ciclo que estamos buscando debe incluir dos procesos isotermos, uno de absorción de calor a Tc y uno de cesión a Tf. Para conectar esas dos isotermas (esto es, para calentar el sistema antes de la absorción y enfriarlo antes de la cesión), debemos incluir procesos que no supongan un intercambio de calor con el exterior (ya que todo el intercambio se produce en los procesos isotermos). La forma más sencilla de conseguir esto es mediante dos procesos adiabáticos reversibles (no es la única forma, el motor de Stirling utiliza otro método, la recirculación). Para que el ciclo sea reversible debemos suponer que no existe fricción en el sistema y todos los procesos son cuasiestáticos. Para un sistema de este tipo los cuatro pasos son los siguientes:
- 1→2 Absorción de calor Qinen un proceso isotermo a temperatura Tc.
- 2→3 Enfriamiento adiabático hasta la temperatura del foco frío, Tf.
- 3→4 Cesión de calor | Qout | al foco frío a temperatura Tf.
- 4→1 Calentamiento adiabático desde la temperatura del foco frío, Tf a la temperatura del foco caliente, Tc.
Como ejemplo de Ciclo de Carnot (ver Figura 2) consideraremos el caso de una máquina térmica compuesta por un gas ideal situado en el interior de un cilindro con un pistón.
Teniendo en cuenta que la eficiencia del ciclo de Carnot está dada por la expresión [1-10]
(1)
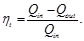
En el caso del gas ideal, el calor que entra lo hace a una temperatura Tc, el cual es absorbido en una expansión isoterma, en la cual no varía la energía interna, ya que el gas al mismo tiempo que absorbe calor realiza trabajo sobre el ambiente
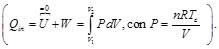
Asimismo, el calor Qout es el cedido en una compresión isoterma, en la que tampoco varía la energía interna, pero el ambiente realiza trabajo sobre el sistema
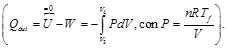
Donde:
(2)
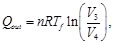
(3)
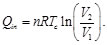
(4)
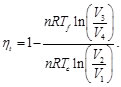
Por otro lado, para los procesos adiabáticos,
(5)
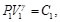
(6)
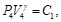
(7)
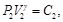
(8)
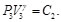
Debido a que la Ec. (5) es igual a la Ec. (6) y la Ec. (7) es igual a la Ec. (8), resulta
(9)
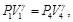
(10)
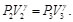
Dado que la sustancia de trabajo es un gas ideal con calores específicos constantes, se tiene, para los procesos isotérmicos
(11)
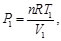
(12)
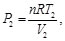
(13)
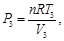
(14)
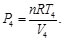
Sustituyendo las Ecs. (11)-(14) en las Ecs. (9) y (10), resulta en:
(15)
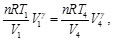
(16)
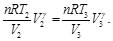
Simplificando las Ecs. (15) y (16), se obtiene:
(16)
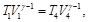
(17)
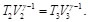
Como T1=t2 y T3=T4, las Ecs. (16) y (17), se pueden reescribir como:
(18)
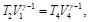
(19)
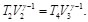
Despejando T2 de las Ecs. (18) y (19) e igualando ambos resultados, se tiene:
(20)
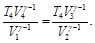
Por lo tanto,
(21)
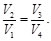
Con ayuda de la Ec. (21), la Ec. (4) resulta en:
(22)
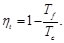
2.2 Ciclo de Otto
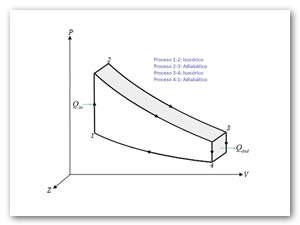
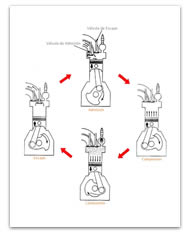
En ciclo Otto ideal es una aproximación teórica al comportamiento de un motor de explosión (ver Figura 3). Las fases de operación de este motor son las siguientes:
- 1→2 Calentamiento a volumen constante.
- 2→3 Expansión adiabática.
- 3→4 Enfriamiento a volumen constante.
- 4→1 Compresión adiabática.
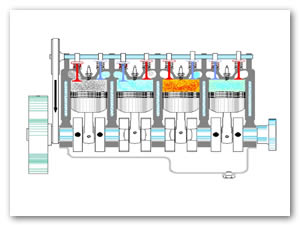
En un motor real de explosión varios cilindros actúan simultáneamente, de forma que la expansión de alguno de ellos realiza el trabajo de compresión de otros (ver Figura 4).
Al analizar el ciclo Otto ideal, podemos despreciar en el balance los procesos de admisión y de escape a volumen constante 1→2 y 3→4, ya que al ser idénticos y reversibles, en sentido opuesto, todo el calor y el trabajo que se intercambien en uno de ellos, se cancela con un término opuesto en el otro. Teniendo en cuenta que la eficiencia del ciclo Otto está dada por la expresión [1-10]
(23)
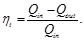
El ciclo de Otto es el que se puede emplear para aproximarse al funcionamiento de un motor de combustión interna encendido por chispa. Tomando como base la unidad de masa del gas, se tiene para el ciclo de Otto que
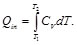
Asimismo, para el calor cedido
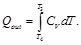
donde
(24)
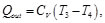
(25)
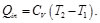
Sustituyendo las Ecs. (24) y (25) en la Ec. (23), se obtiene:
(26)
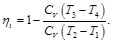
Por otro lado, para los procesos adiabáticos,
(27)
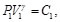
(28)
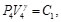
(29)
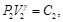
(30)
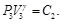
Debido a que la Ec. (27) es igual a la Ec. (28) y la Ec. (29) es igual a la Ec. (30), resulta
(31)
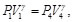
(32)
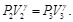
Dado que la sustancia de trabajo es un gas ideal con calores específicos constantes, se tiene, para los procesos isotérmicos
(33)
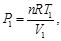
(34)
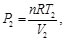
(35)
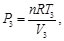
(36)
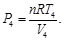
Sustituyendo las Ecs. (33)-(36) en las Ecs. (31) y (32), resulta en:
(37)
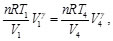
(38)
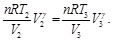
Simplificando las Ecs. (37) y (38), se obtiene:
(39)
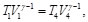
(40)
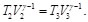
Como V1=V2 y V3=V4, las Ecs. (39) y (40), se pueden reescribir como:
(41)
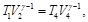
(42)
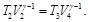
Despejando V2 de las Ecs. (41) y (42) e igualando ambos resultados, se tiene:
(43)
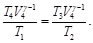
Por lo tanto,
(44)
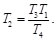
Sustituyendo la Ec. (44) en la Ec. (26) resulta en:
(45)
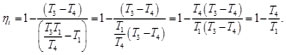
2.3 Ciclo de Diesel
Un ciclo Diésel ideal es un modelo simplificado de lo que ocurre en un motor diésel. En un motor de esta clase, a diferencia de lo que ocurre en un motor de gasolina la combustión no se produce por la ignición de una chispa en el interior de la cámara (ver Figura 5).
En su lugar, aprovechando las propiedades químicas del gasóleo, el aire es comprimido hasta una temperatura superior a la de autoignición del gasóleo y el combustible es inyectado a presión en este aire caliente, produciéndose la combustión de la mezcla. Las fases de operación de este motor son las siguientes (ver Figura 6):
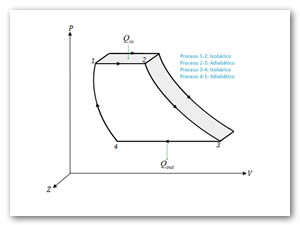
- 1→2 Calentamiento a presión constante.
- 2→3 Expansión adiabática.
- 3→4 Enfriamiento a volumen constante.
- 4→1 Compresión adiabática.
Al analizar el ciclo Diesel ideal, podemos despreciar en el balance los procesos de admisión y de escape a presión constante 1→2 y a volumen constante 3→4, ya que al ser idénticos y reversibles, en sentido opuesto, todo el calor y el trabajo que se intercambien en uno de ellos, se cancela con un término opuesto en el otro. Teniendo en cuenta que la eficiencia del ciclo Diesel está dada por la expresión [1-10]
(46)
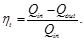
El ciclo de Diesel es el que se puede emplear para aproximarse al funcionamiento de un motor de combustión interna encendido por chispa. Tomando como base la unidad de masa del gas, se tiene para el ciclo de Diesel que
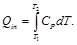
Asimismo, para el calor cedido
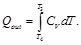
Donde:
(47)
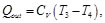
(48)
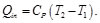
Sustituyendo las Ecs. (47) y (48) en la Ec. (46), se obtiene:
(49)
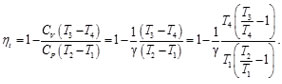
Por otro lado, para los procesos adiabáticos,
(50)
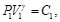
(51)
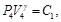
(52)
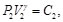
(53)
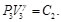
Debido a que la Ec. (50) es igual a la Ec. (51) y la Ec. (52) es igual a la Ec. (53), resulta
(54)
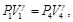
(55)
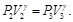
Dado que la sustancia de trabajo es un gas ideal con calores específicos constantes, se tiene, para los procesos isotérmicos
(56)
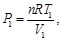
(57)
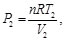
(58)
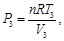
(59)
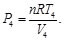
Sustituyendo las Ecs. (56)-(59) en las Ecs. (54) y (55), resulta en:
(60)
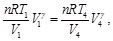
(61)
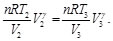
Simplificando las Ecs. (60) y (61), se obtiene:
(62)
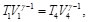
(63)
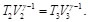
Las Ecs. (62) y (63), se pueden reescribir como:
(64)
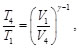
(65)
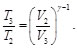
De las Ecs. (64) y (65), se tiene:
(66)
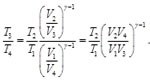
Considerando que P1 y P2(ver Figura 6). Asimismo, de las Ecs. (56) y (57),
(67)
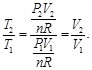
Sustituyendo las Ecs.(64), (66) y (67) en la Ec. (67) resulta en:
(68)
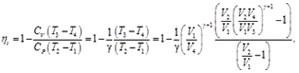
Finalmente la eficiencia térmica para el ciclo Diesel es:
(69)
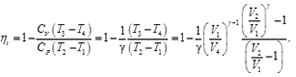
2.4 Ciclo de Brayton
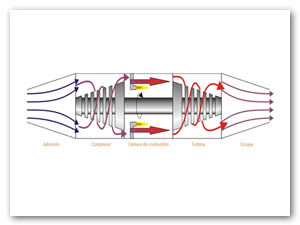
Un ciclo Brayton (o Joule) ideal modela el comportamiento de una turbina, como las empleadas en las aeronaves (ver Figura 7). Este ciclo está formado por cuatro pasos reversibles, según se indica en la Figura 8.
Las fases de operación de este motor son las siguientes (ver Figura 8):
- 1→2 Calentamiento a presión constante.
- 2→3 Expansión adiabática.
- 3→4 Enfriamiento a presión constante.
- 4→1 Compresión adiabática.
Teniendo en cuenta que la eficiencia del ciclo Brayton está dada por la expresión [1-10]
(70)
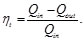
El ciclo de Brayton es el que se puede emplear para aproximarse al funcionamiento de una turbina de una aeronave. Tomando como base la unidad de masa del gas, se tiene para el ciclo de Brayton que
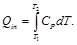
Asimismo, para el calor cedido
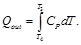
Donde:
(71)
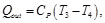
(72)
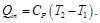
Sustituyendo las Ecs. (71) y (72) en la Ec. (70), se obtiene:
(73)
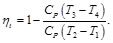
Por otro lado, para los procesos adiabáticos,
(74)
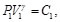
(75)
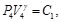
(76)
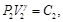
(77)
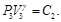
Debido a que la Ec. (74) es igual a la Ec. (75) y la Ec. (76) es igual a la Ec. (77), resulta
(78)
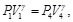
(79)
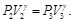
Dado que la sustancia de trabajo es un gas ideal con calores específicos constantes, se tiene, para los procesos isotérmicos
(80)
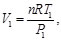
(81)
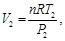
(82)
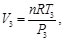
(83)
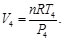
Sustituyendo las Ecs. (80)-(83) en las Ecs. (78) y (79), resulta en:
(84)
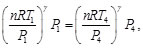
(85)
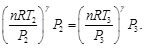
Simplificando las Ecs. (84) y (85), se obtiene:
(86)
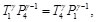
(87)
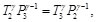
Las Ecs. (86) y (87), se pueden reescribir como:
(88)
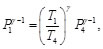
(89)
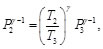
De acuerdo con la Figura 8, se observa que P1=P2, igualando las Ecs. (88) y (89), se tiene:
(90)
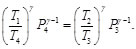
Considerando que P3 y P4 (ver Figura 8), la Ec. (90) se puede reescribir como:
(91)
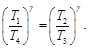
De la Ec. (91) se tiene:
(92)
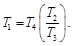
Finalmente sustituyendo la Ec. (92) en la Ec. (73), se tiene que la eficiencia térmica para el ciclo Brayton es:
(93)
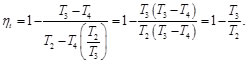
3. Resultados y discusiones
Resulta útil tratar los procesos termodinámicos basándose en ciclos: procesos que devuelven un sistema a su estado original después de una serie de fases, de manera que todas las variables termodinámicas relevantes vuelven a tomar sus valores originales. En un ciclo completo, la energía interna de un sistema no puede cambiar, puesto que sólo depende de dichas variables. Por tanto, el calor total neto transferido al sistema debe ser igual al trabajo total neto realizado por el sistema. Un motor térmico de eficiencia perfecta realizaría un ciclo ideal en el que todo el calor se convertiría en trabajo mecánico. El ciclo de Carnot, es un ciclo termodinámico que constituye el ciclo básico de todos los motores térmicos, y demuestra que no puede existir ese motor perfecto. Cualquier motor térmico pierde parte del calor suministrado. Tanto para el ciclo de Carnot, Otto, Diesel y Brayton se determinó el rendimiento térmico (Nt=Qin-Qout/Qin ) partiendo de la primera ley de la termodinámica y de dos ecuaciones fundamentales para su análisis como son: Ley de gas ideal (PV=nRT) y ley de que describe a los proceso adiabáticos (PVy=cte).
Conclusiones
Un modo de cuantificar el comportamiento de un ciclo termodinámico (máquina térmica) es relacionar el efecto deseado y el consumo de energía requerido para lograr dicho efecto. Para los ciclos térmicos considerados de generación, la medida del comportamiento de dichos ciclos es la eficiencia térmica (rendimiento térmico) que se define como la relación entre el trabajo total obtenido por el ciclo (efecto deseado) y el calor suministrado al ciclo. En este trabajo, se definió una técnica para determinar el rendimiento térmico de los ciclos termodinámicos analizados al combinar las ecuaciones que describen a los procesos adiabáticos con los que describen a los procesos isotérmicos. En el análisis del rendimiento térmico, se parte del hecho de que los ciclos térmicos tienen en común a dos procesos adiabáticos.
Agradecimientos
El trabajo descrito en el presente artículo fue financiado por la beca otorgada por PROMEP. Asimismo, los autores le agradecen al Ing. Martín Ortiz Granillo, quien es Director de la Escuela Superior de Ciudad Sahagún-UAEH, México, por todas las facilidades para terminar este trabajo de investigación.
Referencias
1. Huang, F. F. (2001). Ingeniería Termodinámica Fundamentos y Aplicaciones. D. F., México: Compañía Editorial Continental, S. A de C. V.
2. Cengel, Y. A., Boles, M. A. (2001). Thermodynamics: An Engineering Approach. New York, US: McGraw Hill.
3. Wark, K. (1991). Termodinámica. D. F., México: McGraw Hill.
4. Moran, M. J., Shappiro, H. N. (2005). Fundamentos de Termodinámica Técnica. Barcelona, España: Reverté, S. A.
5. Abalat, P. R. (2000). Termodinámica Aplicada. Barcelona, España: Ediciones de la Universidad de Barcelona
6. Joffré, J. E. (1993). Termodinámica Metalúrgica. San Luis Potosí, México: Universidad Autónoma de San Luis Potosí.
7. Sala, J. M., López, L. M., Aranguren, V. P. (2000). Termodinámica Aplicada. La Rioja, España: Universidad de la Rioja, Servicio de Publicaciones.
8. Zueco, J. (2010). 100 Problemas Resueltos de Termodinámica Aplicada. Madrid, España: Bellisco.
9. Havit A. S., Utfinger, C. G. (1995). Thermodynamics. From Concepts to Applications. London, Great Britain: Prentice Hall.
10. Segura, J. M. (1980). Termodinámica Técnica. Madrid, España: AC.
11. Máquina térmica. Recuperado el 20 de marzo de 2015, de https://sites.google.com/site/maquinastermicaspereyrafranco/trabajo.
12. Motor real de explosión. Recuperado el 20 de marzo de 2015, de http://laplace.us.es/wiki/index.php/Ciclo_Otto.
13. Ciclo Diesel. Recuperado el 20 de marzo de 2015, de http://jypygokovo.opx.pl/funcionamiento-de-un-motor-diesel.php.
14. Esquema de una turbina de una aeronave. Recuperado el 20 de marzo de 2015, de http://laplace.us.es/wiki/index.php/Ciclo_Brayton.
[a] Profesor de la Universidad Autónoma del Estado de Hidalgo.
[b] Alumno de la Universidad Autónoma del Estado de Hidalgo.