PROPIEDADES DEL BENCENO Y SUS USOS EN LA INDUSTRIA
Resumen
El benceno es sin duda alguna un compuesto muy versátil y de mucha importancia en la química ya que dé el surgen algunos compuestos derivados del mismo y además es uno de los mejores disolventes para el yodo, azufre, fósforo, gomas, ceras, etc. Gracias a su variedad de usos y aplicaciones este compuesto está incluido en los llamados compuestos aromáticos.
Palabras clave: benceno, química, compuesto, aromático
Abstract
Benzene is definitely very versatile and very important in chemistry because some compounds derived from it and it is one of the best solvents for iodine, sulfur, phosphorus, gums, waxes, etc. With its variety of uses and applications this compound is included in the so-called aromatic compounds.
Keywords: benzene, chemistry, compound, aromatic
Definición de Benceno
Líquido incoloro de olor característico y sabor a quemado, de fórmula C6H6. La molécula de benceno consiste en un anillo cerrado de seis átomos de carbono unidos por enlaces químicos que resuenan entre uniones simples y dobles. Cada átomo de carbono está a su vez unido a un átomo de hidrógeno.
El benceno (C6H6) fue descubierto por el científico inglés Michael Faraday en 1825 aislándolo del gas de alumbrado. Pero hasta 1842 en que se descubrió la existencia del benceno en el alquitrán de hulla El benceno puro arde con una llama humeante debido a su alto contenido de carbono.
Mezclado con grandes proporciones de gasolina constituye un combustible aceptable.
Propiedades químicas
El benceno y sus homólogos (compuestos aromáticos), poseen una gran estabilidad química y solo reaccionan a condiciones especiales y con el uso de catalizadores apropiados. Sus reacciones la podemos clasificar en dos grupos:
- Reacciones con destrucción de carácter aromático
- Reacciones de sustitución electrofílica
Reacciones con destrucción de carácter aromático
Combustión:El calor de combustión (▲H) es muy grande y arde suavemente, por lo tanto su poder indetonante (antidetonante) es considerable como la de sus homólogos, lo que explica la práctica de la aromatización en la industria de los carburantes para elevar su octanaje.
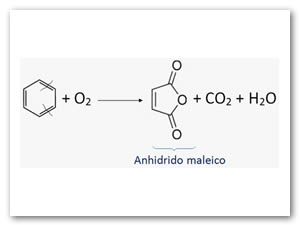
Oxidación:Atemperaturaalta (400°C) y haciendo uso de un catalizador (V2O5ó MoO3), la oxidación directa permite obtener anhídrido maleico que se utiliza en la fabricación de resinas sintéticas.
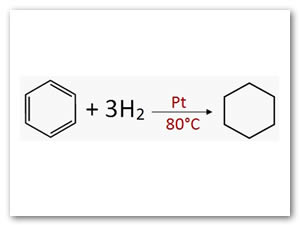
Hidrogenación:Conduce a la formación del ciclohexano, para lo que se necesita catalizadores muy activos (Ni, Pt ó MoS) y temperatura relativamente alta (80°C).
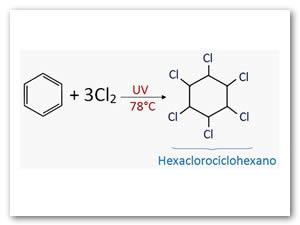
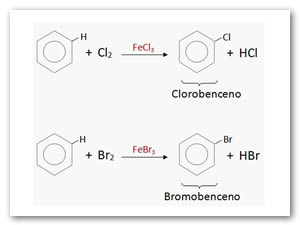
Halogenación:Sólo reacciona con Cl2ó Br2catalizada por radiación ultravioleta y a 78°C.
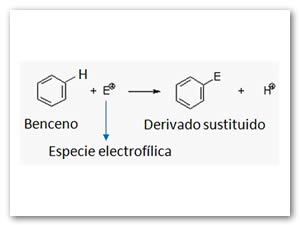
Reacciones de sustitución aromática electrofílica
Son las reacciones más importantes en síntesis orgánica por la gran variedad de productos que se originan.
El anillo bencénico sirve como fuente electrónica para los reactivos electrofílicos (sustancias deficientes en electrones), debido a que los electrones π se hallan prácticamente sueltos.
El proceso neto se puede representar de la siguiente manera:
Principales reacciones del benceno
Halogenación: La cloración y la bromación directa solo es posible en presencia de un catalizador que debe ser un ácido de Lewis (FeCl3 , AlCl3 , FeBr3)
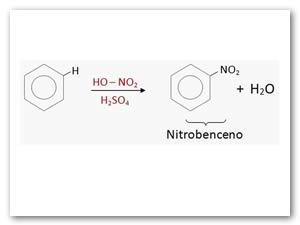
Nitración: Es la reacción del benceno con ácido nítrico (HNO3) concentrado. Se utiliza como catalizador el ácido sulfúrico concentrado (H2SO4).
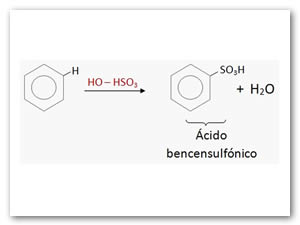
Sulfonación: Es la reacción con el ácido sulfúrico concentrado. Esta reacción es lenta, pero con el ácido sulfúrico fumante (H2SO4 + SO3) se vuelve más rápida.
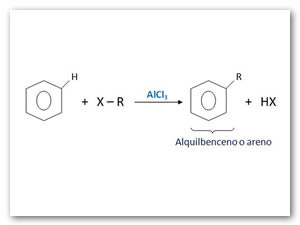
Alquilación y acilación de Friedel-Crafts: Los químicos Charles Friedel (francés) y James Crafts (norteamericano), en 1877, descubrieron nuevos métodos para obtener alquilbencenos o arenos (R-Ar) y acilbencenos o cetonas aromáticas (Ar-CO-R).
El grupo arilo o aromático se simboliza por Ar, como ya señalamos anteriormente (en compuestos oxigenados).
La alquilación consiste en la reacción del benceno con un halogenuro de alquilo (R-X).
Propiedades físicas
- El benceno es un líquido incoloro de olor fuerte, más ligero que el agua (D=0.889 g/cm3).
- El benceno hierve a 80.1°C y funde a 5.4°C; á 1 atm de presión.
- El benceno es tóxico, y resulta muy peligroso respirar sus vapores en periodos largos. Se caracteriza por ser insoluble en agua, pero muy soluble en disolventes orgánicos como etanol, éter, disulfuro de carbono, ciclohexano, etc..
Fuentes de consulta
Klein, David. 2014. Química Orgánica. Médica Panamericana. 1° Edición. Páginas 1350.
Fieser, Mary, Fieser, Louis F. 1985. Química Orgánica fundamental. Editorial Reverté. España.
Alcántara, Ma. Del consuelo. (1992). Química de hoy. McGraw Hill Interamericana de México, S.A.
Sosa, Sergio. (1999). Química 2000. Hill Interamericana de Venezuela, S.A.
[a] Profesor Escuela Preparatoria No. 3
Compartir en: