Efecto Quimiopreventivo de un extracto de cáscara de granada (Punica granatum)
Chemopreventive Effect of a Peel Pomegranate Fruit Extract (Punica granatum)
Resumen
Los componentes de la granada (Punica granatum L.) han sido estudiados experimentalmente por sus efectos antiinflamatorios y anticarcinogénicos. Sin embargo, no existen estudios concluyentes sobre la eficacia del extracto del jugo y la cáscara del fruto para proteger la integridad del material genético de células de mamíferos; así como de su capacidad protectora frente al daño inducido por la doxorrubicina (DOXO), un agente antineoplásico utilizado clínicamente para el tratamiento de leucemia linfocítica aguda principalmente en niños. Por lo tanto los objetivos del presente trabajo fueron: Obtener los extractos de granada, determinar su contenido de polifenoles y capacidad antioxidante in vitro y evaluar el potencial genotóxico y antigenotóxico mediante el ensayo de micronúcleos in vivo. Los resultados revelaron ausencia de toxicidad letal hasta con 5 g/kg en ratón macho CD1+, genotoxicidad y citotoxidad en eritrocitos de sangre periférica durante 15 días de tratamiento, en cambio 70 y 700 mg/kg del extracto de cáscara protegieron 40-56% contra el daño clastogénico ocasionado por la administración sistémica única de 10 mg/kg de doxorubicina. Los resultados se analizaron por ANOVA de dos vías, consideraron los datos estadísticamente significativos si p<0.05.
Palabras clave: antioxidante, genotoxicidad, prueba de micrónúcleos, polifenoles
Abstract
Pomegranate fruit (Punica granatum L.) compounds have been experimentally by their antiinflammatory and anticarcinogenic effects. However, there aren´t conclusive studies about the effectiveness of the juice and peel pomegranate fruit extracts to protect the genetic material integrity of the mammals cells; and their protective capacity against the damage induced by doxorubicin (DOXO), an antineoplastic agent clinically used for the treatment of acute lymphocytic leukemia mainly in children. Therefore the objectives of this study were: to obtain pomegranate fruit extracts, to determine its content of polyphenols and antioxidant capacity in vitro and to evaluate the genotoxic and antigenotoxic potential by in vivo micronucleus assay.The results revealed no lethal toxicity up to 5 g/kg in male mice CD1 +, genotoxicity and cytotoxicity in peripheral blood erythrocytes during 15 days of treatment, whereas 70 and 700 mg/kg of peel extract protected 40-56% against clastogenic damage induced by the only systemic administration of 10 mg/kg doxorubicin. Results were analyzed by two-way ANOVA, data were considered statistically significant if p <0.05.
Keywords: antioxidant, genotoxicity, micronucleus test, polyphenols
Introducción
Desde tiempos ancestrales el fruto del granado se ha utilizado para tratar diversas condiciones: antibacterial (Prashanth et al., 2001; Braga et al., 2005; Menezes et al., 2006; Aqil et al., 2007), antidiarreico (Das et al., 1999; Mathabe et al., 2006) antifúngico (Dutta et al., 1998; Vasconcelos et al., 2003; Vasconcelos et al., 2006), y antioxidante, además se ha evidenciado su acción antitumoral (Afaq et al., 2005). Estas propiedades terapéuticas son atribuidas a compuestos como el ácido elágico, elagitaninos, ácido punícico, flavonoides, antocianinas, antocianidinas y flavonoles presentes en cantidades significativas en el fruto (Jurenka, 2008). Se han aislado y caracterizado algunos de estos metabolitos como el ácido elágico y punicalagina y se ha evidenciado que poseen efecto antiproliferativo en algunos tipos celulares de cáncer de boca, colon y próstata (Ismail et al., 2012). Moléculas similares han sido descritas y son utilizadas como agentes antitumorales, tal es el caso de la DOXO y daunorrubicina (DAU), fármacos utilizados en el tratamiento de diversos tipos de cáncer, cuyo metabolismo conduce a la formación de semiquinona, radical libre que fácilmente reduce al oxígeno a especies reactivas de oxígeno como el anión superóxido y el peróxido de hidrógeno, los cuales en presencia de metales de transición como el hierro pueden generar al radical hidroxilo que es altamente tóxico (Torres y Simic, 2012), la formación de radicales libres destruye a las células en proliferación. Tanto los metabolitos de las plantas como los medicamentos obtenidos por síntesis química forman parte del intento de revertir o frenar un proceso canceroso, sin embargo, recientemente el uso de productos naturales con propiedades antioxidantes ha tenido un auge importante, como una opción para la prevención y como coadyuvante en el tratamiento de enfermedades crónico-no transmisibles relacionadas con estrés oxidativo y con el daño genotóxico, tal es el caso de la granada que además de dichas propiedades su producción en el estado de Hidalgo es importante, ocupando segundo lugar a nivel nacional (SAGARPA, 2013).
Justificación
Se ha probado el efecto benéfico de la granada en diversas enfermedades, propiedad atribuida principalmente a su elevado contenido de compuestos antioxidantes, los cuales son reportados como posibles protectores de daños en el ADN, por lo cual resulta relevante establecer si la granada tiene capacidad antigenotóxica pues son pocos los estudios que se han realizado en relación a esta propiedad. Además en ningún estudio se ha utilizado doxorubicina como agente mutágeno. El uso de la doxorrubicina, representa un reto importante para determinar la propiedad antigenotóxica ya que este fármaco productor de radicales libres nos permitirá estudiar la posible capacidad antioxidante de los extractos de granada en un sistema de prueba in vivo.
De encontrarse la evidencia experimental, podría considerarse a la granada como un agente quimiopreventivo, y así promoverse su consumo, dado que es un fruto con producción relevante en el estado de Hidalgo.
Objetivos
Objetivo general: Evaluar la acción quimiopreventiva in vivo de la granada (Punica granatum L) contra el daño producido por la doxorubicina mediante el ensayo cometa y micronúcleos.
Objetivos específicos:
- Obtener extractos de arilo, pericarpio y cáscara de granada, por maceración y posterior rotaevaporación.
- Determinar el contenido de fenoles totales y la capacidad de captura de radicales libres.
- Evaluar la citotoxicidad y efecto genotóxico y antigenotóxico de los extractos mediante la técnica de micronúcleos en sangre de ratón CD1+.
Hipótesis
Los componentes del extracto de granada al ser antioxidantes reducirán el daño al ADN ocasionado por los radicales libres formados durante el metabolismo del mutágeno doxorubicina.
Materiales y métodos
Se obtuvo jugo de arilo y extractos de las diferentes partes del fruto de granada por macerado y posterior rotaevaporación y se les determinó el contenido de compuestos fenólicos totales (CFT) utilizando el método espectrofotométrico desarrollado por Folin y Ciocalteau (Singleton y Joseph, 1965; Aaby et al., 2005) así como la capacidad de captación de radicales libres por los métodos: (a) catión radical del ácido 2,2’-azino-bis (3-etilbenzotiazolina-6-sulfónico) (ABTS•+) (Re et al., 1999) y (b) 2,2-difenil-1-picrilhidrazil (DPPH•+) desarrollado por Brand-Willams et al. (1995). El análisis estadístico de los datos obtenidos de cada determinación se llevó a cabo por ANOVA de dos vías lo que permitió establecer el extracto con mejor actividad antioxidante para realizar los ensayos genotóxico y antigenotóxico in vivo, dicho trabajo se realizó bajo los lineamientos de cuidado animal establecidos por el Bioterio del ICSa de la UAEH basados en la NORMA Oficial Mexicana para la producción, cuidado y uso de animales de laboratorio NOM-062-ZOO-1999.
Se determinó la DL50 por el método de Lorke (1983) modificado administrando a los ratones el extracto de granada por vía intragástrica en dosis de 10, 100, 1000 1600, 2900 y 5000 mg/kg de masa y observándolos durante 14 días. De esta manera se determinaron las dosis a utilizar en el ensayo genotóxico y antigenotóxico, la administración del extracto de granada se realizó por vía intragástrica durante 15 días y la doxorubicina en una dosis única por vía intraperitoneal. Los animales se distribuyeron de manera aleatoria en: grupo control negativo (sin tratamiento), grupo control positivo tratado con doxorubicina (10mg/kg) o daunorubicina (3 mg/kg), tres grupos administrados con diferentes dosis del extracto de granada y tres grupos tratados con los extractos de granada más doxorubicina (10mg/kg), se realizaron frotis de sangre periférica para observarlos al microscópio óptico cuantificando un total de 1000 células diferenciándolas por su coloración en eritrocitos policromáticos (EPC) y eritrocitos normocromáticos (ENC), además de la frecuencia de micronúcleos (MN) que son fragmentos de cromatina, separados del núcleo principal (Muller, 1964; MacGregor et al., 1990).
Resultados
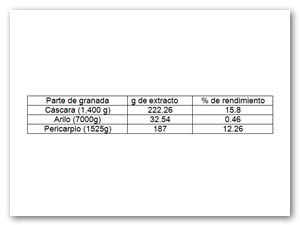
Se obtuvieron los extractos orgánicos con porcentajes de rendimiento de 15.8 para el extracto de cáscara (EMC), 12.26 para el extracto de pericarpio (EMP), y 0.46 para el extracto de arilo (EBJ) (Tabla 1). A partir de estos extractos se determinó el contenido de fenoles totales y la capacidad de captación de radicales libres. En la figura 1 se muestran los resultados de estas determinaciones para el arilo de granada con semilla y sin semilla y en la figura 2 los resultados comparativos para los extractos. El contenido de fenoles totales del jugo de granada con semilla se cuantificó alrededor de 8000 EAG/L superando al jugo sin semilla (3402 EAG/L) (Seeram et al., 2008). El EMC presentó tanto el mayor contenido de fenoles totales como de actividad antioxidante con ambas técnicas utilizadas.
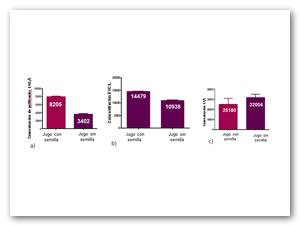
Figura 1: Contenido de fenoles totales, y capacidad antioxidante de jugo de arilo con semilla y sin semilla. a) Contenido de fenoles totales, b) ensayo ABTS•+ y c) ensayo DPPH•+
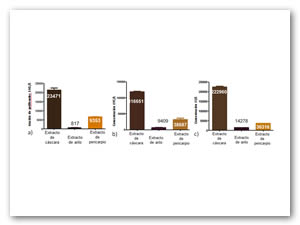
Figura 2: Contenido de fenoles totales, y capacidad antioxidante deextractos. a) Contenido de fenoles totales, b) ensayo ABTS•+ y c) ensayo DPPH•+
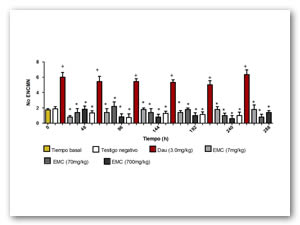
Se elige al EMC para la evaluación in vivo. Después de la administración subcrónica en ratón CD1+ del extracto a dosis de 10, 100 y 1000, 1600, 2900 y 5000 mg/kg de masa, no se presentaron síntomas o alteraciones en la conducta, ni muerte en los animales estudiados, por lo que se establece que la dosis letal media es superior a 5000mg/kg. Se administran 7, 70 y 700mg/kg de masa para las evaluaciones genotóxica y antigenotóxica. En la figura 3 se muestran los valores promedio de la frecuencia de MN al administrar el extracto a ratones macho. Se aprecia que las 3 dosis del EMC no presentaron diferencias significativas con respecto al testigo negativo en ninguno de los tiempos observados. Por el contrario la dosis empleada de DAU (3 mg/kg) mostró un incremento significativo desde las 48h después de administrada. El resultado establece que el EMC no indujo MN.
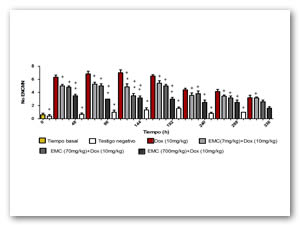
En la figura 4 se representa el promedio obtenido en la relación EPC/ENC. Los resultados muestran que ninguna de las tres dosis del EMC presenta diferencias significativas en relación al testigo negativo, por lo tanto se concluye que el EMC no modificó la eritropoyesis. Con respeto a la DAU ésta sustancia modificó la eritropoyesis, observándose un aumento significativo de la relación EPC/ENC con respecto al testigo negativo, a partir de las 48h, mostrando un efecto máximo a las 144h.
Diferencias estadísticamente significativas con respecto al testigo positivo (*) y negativo (+). Pruebas ANOVA y Tukey- Kramer (α=0.05)
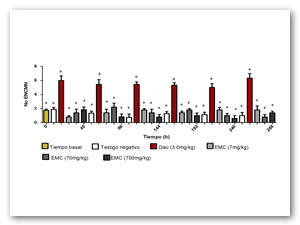
Figura 4: Efecto del EMC sobre la relación EPC/ENC en sangre periférica de ratón. Diferencias estadísticamente significativas con respecto al testigo positivo (*) y negativo (+). Pruebas ANOVA y Tukey- Kramer (α=0.05)
La figura no. 5 muestra el promedio de los valores obtenidos de la frecuencia de micronúcleos, en ratones administrados con una dosis única inicial de 10mg/kg de DOXO, grupo que revela un aumento significativo de dicha frecuencia con respecto al testigo negativo y una disminución en los grupos tratados con el extracto, siendo ésta significativa con las dosis de 70 y 700mg/kg a la 96 hrs.
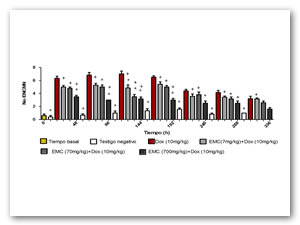
Figura5: Efecto inhibitorio del EMC sobre la frecuencia de ENCMN producidos por DOXO. DES con respecto al testigo positivo (*) y vehículo (+). Pruebas ANOVA y Tukey- Kramer (α=0.05)
Conclusiones
- El EMC presentó una concentración de polifenoles y actividad antioxidante significativamente mayor a la del jugo de arilos con y sin semilla, el extracto butanólico del jugo y el metanólico del pericarpio de la granada.
- El EMC no presentó toxicidad letal hasta con 5 g/kg en ratón macho CD1+, tampoco genotoxicidad ni citotoxidad en eritrocitos de sangre periférica durante 15 días de tratamiento.
- 70 y 700 mg/kg de EMC protegen 40-56% contra el daño clastogénico producido por la administración sistémica única de 10 mg/kg de doxorubicina.
Bibliografía
Aaby, K., Skrede, G., & Wrolstad, R. E. (2005). Phenolic composition and antioxidant activities in flesh and achenes of strawberries (Fragaria ananassa).Journal of Agricultural and Food Chemistry, 53(10), 4032-4040.
Afaq, F., Saleem, M., Krueger, C. G., Reed, J. D., & Mukhtar, H. (2005). Anthocyanin‐and hydrolyzable tannin‐rich pomegranate fruit extract modulates MAPK and NF‐κB pathways and inhibits skin tumorigenesis in CD‐1 mice.International Journal of Cancer, 113(3), 423-433.
Aqil, F., & Ahmad, I. (2007). Antibacterial properties of traditionally used Indian medicinal plants. Methods and findings in experimental and clinical pharmacology, 29(2), 79-92.
Braga, L. C., Leite, A. A., Xavier, K. G., Takahashi, J. A., Bemquerer, M. P., Chartone-Souza, E., & Nascimento, A. M. (2005). Synergic interaction between pomegranate extract and antibiotics against Staphylococcus aureus. Canadian journal of microbiology, 51(7), 541-547.
Brand-Williams, W., Cuvelier, M. E., & Berset, C. L. W. T. (1995). Use of a free radical method to evaluate antioxidant activity. LWT-Food Science and Technology, 28(1), 25-30.
Das, A. K., Mandal, S. C., Banerjee, S. K., Sinha, S., Das, J., Saha, B. P., & Pal, M. (1999). Studies on antidiarrhoeal activity of Punica granatum seed extract in rats. Journal of ethnopharmacology, 68(1), 205-208.
Dutta, B. K., Rahman, I., & Das, T. K. (1998). Antifungal activity of Indian plant extracts: Antimyzetische Aktivität indischer Pflanzenextrakte. Mycoses, 41(11‐12), 535-536.
Ismail, T., Sestili, P., & Akhtar, S. (2012). Pomegranate peel and fruit extracts: a review of potential anti-inflammatory and anti-infective effects. Journal of Ethnopharmacology, 143(2), 397-405.
Jurenka, J. S. (2008). Therapeutic applications of pomegranate (Punica granatum L.): a review. Alternative medicine review: a journal of clinical therapeutic, 13(2), 128-144.
Lorke, D. (1983). A new approach to practical acute toxicity testing. Archives of toxicology, 54(4), 275-287.
MacGregor, J. T., Wehr, C. M., Henika, P. R., & Shelby, M. D. (1990). The in vivo erythrocyte micronucleus test: measurement at steady state increases assay efficiency and permits integration with toxicity studies. Toxicological Sciences, 14(3), 513-522.
Mathabe, M. C., Nikolova, R. V., Lall, N., & Nyazema, N. Z. (2006). Antibacterial activities of medicinal plants used for the treatment of diarrhoea in Limpopo Province, South Africa. Journal of ethnopharmacology, 105(1), 286-293.
Menezes, S. M., Cordeiro, L. N., & Viana, G. S. (2006). Punica granatum (pomegranate) extract is active against dental plaque. Journal of herbal pharmacotherapy, 6(2), 79-92.
Muller, H. J. (1964). The relation of recombination to mutational advance.Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,1(1), 2-9.
NOM, Norma Oficial Mexicana. 062-ZOO-1999, Especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio. Diario Oficial de la Federacion, 1999.
Prashanth, D., Asha, M. K., & Amit, A. (2001). Antibacterial activity of Punica granatum. Fitoterapia, 72(2), 171-173.
Re, R., Pellegrini, N., Proteggente, A., Pannala, A., Yang, M., & Rice-Evans, C. (1999). Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free radical biology and medicine, 26(9), 1231-1237.
Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (Internet). México 2012. Disponible en: http://www.sagarpa.gob.mx/Paginas/default.aspx
Seeram, N. P., Aviram, M., Zhang, Y., Henning, S. M., Feng, L., Dreher, M., & Heber, D. (2008). Comparison of antioxidant potency of commonly consumed polyphenol-rich beverages in the United States. Journal of agricultural and food chemistry, 56(4), 1415-1422.
Singleton, V. L., & Rossi, J. A. (1965). Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American journal of Enology and Viticulture, 16(3), 144-158.
Torres, V. M., & Simic, V. D. (2012). Doxorubicin-Induced Oxidative Injury of Cardiomyocytes-Do We Have Right Strategies for Prevention?. INTECH Open Access Publisher.
Vasconcelos, L. C. D. S., Sampaio, F. C., Sampaio, M. C. C., & Higino, J. S. (2003). Use of Punica granatum as an antifungal agent against candidosis associated with denture stomatitis. Mycoses, 46(5‐6), 192-196.
Vasconcelos, L. C. D. S., Sampaio, F. C., Sampaio, M. C. C., Pereira, M. D. S. V., Higino, J. S., & Peixoto, M. H. P. (2006). Minimum inhibitory concentration of adherence of Punica granatum Linn (pomegranate) gel against S. mutans, S. mitis and C. albicans. Brazilian Dental Journal, 17(3), 223-227.
[a] Alumno de la Maestría en Ciencias Biomédicas y de la Salud, del Instituto de Ciencias de la Salud, UAEH.
[b]Profesor Investigador del Área académica de Nutrición y (3) Medicina del Instituto de Ciencias de la Salud, UAEH.
Correo de Correspondencia: chabe281004@hotmail.com