Hemoglobina
Resumen
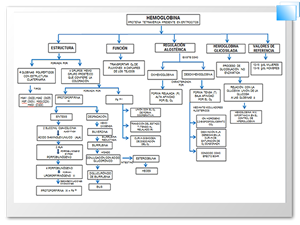
La hemoglobina (Hb) es una proteína globular que se encuentra en el interior de los eritrocitos cuya función es transportar oxígeno desde los pulmones hacia los capilares de los tejidos. Los valores normales en sangre son de 12-15 g/dl en mujeres y de 13-16 g/dl en hombres. Estructuralmente, la Hb es una heteroproteína formada por dos tipos de cadenas peptídicas, cada una unida a un grupo prostético denominado grupo hemo formado por un complejo de protoporfirina IX y hierro ferroso. Las subunidades proteicas se mantienen unidas mediante enlaces no covalentes y ocupan diferentes posiciones relativas en la desoxihemoglobina y la oxihemoglobina. La forma desoxi se denomina forma tensa (T) y presenta baja afinidad por el oxígeno; la unión del oxígeno causa la ruptura de enlaces iónicos y de puentes de hidrógeno favoreciendo la forma relajada (R). La unión del oxígeno a la Hb presenta una curva de saturación sigmoidea, que refleja la unión cooperativa del oxígeno, consecuencia de la estructura cuaternaria de la Hb. La capacidad de la hemoglobina para unir el oxígeno de forma reversible se ve modulada por la presión de CO2 (pCO2), el pH, y la disponibilidad de 2,3-bisfosfoglicerato. Así la liberación de O2 de la hemoglobina se ve intensificada cuando disminuye el pH o aumenta la pCO2 (Efecto Bohr). Por otro lado, con respecto al metabolismo de las porfirinas; la biosíntesis del grupo hemo se realiza en el hígado y en las células productoras de eritrocitos en la médula ósea y comienza con la condensación de la glicina y la succinil-CoA. La etapa de determinación en la síntesis del hemo es la formación de δ-aminolevulínico (ALA) para formar la porfobilinógeno. Esta reacción es catalizada por la sintasa de ALA. El anillo de la porfirina se forma por la condensación de cuatro moléculas de porfobilinógeno con la posterior incorporación de hierro para formar el grupo hemo.La degradación de las hemoproteínas se produce en el hígado y el bazo. La primera etapa en la degradación es la producción del pigmento verde biliverdina, que se reduce a bilirrubina. La bilirrubina se transporta al hígado, donde su solubilidad aumenta con la conjugación con el ácido glucurónico. El diglucurónido de bilirrubina se transporta hacia los canalículos biliares donde es hidrolizado y reducido por bacterias intestinales a estercobilina.
Palabras clave: Efecto Bohr, Hemoglobina.
Abstract
Hemoglobin (Hb) is a globular protein located inside the erythrocytes which function is carry oxygen from the lungs to the tissue capillaries. The normal levels are 12-15 g/dl in women and 13-16 g/dl in men. Structurally, the Hb is a hetero-protein formed by two types of peptide chains, each of them attached to a prosthetic group called hemegroup, consisting of a complex of protoporphyrin IX and ferrous iron. The protein subunits are held together by non-covalent bonds and they occupy different relative positions in oxyhemoglobin and deoxyhemoglobin. The deoxy form called tense form (T), has low affinity by oxygen, the oxygen binding to the Hb causes a disruption of ionic and hydrogen bonding favoring the relaxed form (R).Oxygen binding to hemoglobin presents a sigmoidal curve of saturation which reflects the cooperative binding of oxygen due to the quaternary structure of hemoglobin. The ability of hemoglobin to bind oxygen is reversibly modulated by the pressure of CO2 (pCO2), pH, and availability of 2,3-bisphosphoglycerate. Therefore, the release of oxygen from hemoglobin is intensified when the pH decreases or increases pCO2 (Bohr Effect). On the other hand, regarding the porphyrins metabolism; the heme biosynthesis is performed in the liver and in the erythrocytes-producing cells in bone marrow; begins with the condensation of glycine and succinil-CoA. The determining step in heme synthesis is the formation of δ-aminolevulinic acid (ALA) to form porphobilinogen. This reaction is catalyzed by ALA synthase. The porphyrin ring is formed by condensation of four molecules of porphobilinogen with the subsequent incorporation of the iron to form heme group. The hemoproteins degradation occurs in the liver and spleen. The first stage in the degradation is the production of biliverdin, which is reduced to bilirubin. Bilirubin is transported to the liver where solubility increases with the glucuronic acid conjugation. The diglucuronide bilirubin is transported to the bile canaliculi which is hydrolyzed by intestinal bacteria and reduced to stercobilin.
Keywords: Bohr Effect, Hemoglobin.